Cell Death Dis(IF=9.0):灯盏乙素靶向IDH1下调糖酵解抑制肝癌进展
发布时间:2024-04-19 浏览人数:1021
传统化疗药物毒副作用大,患者依从性低,容易产生耐药。灯盏乙素(Scutellarin,Suc)是一种酚类植物黄酮,具有广泛的药理作用,但其在肝癌进展中的是否发挥抑制作用及靶点机制尚不清楚。
2024年4月15日,中国中医科学院实验研究中心杨洪军/陈鹏合作在Cell Death Dis(IF=9.0)上发表题为“Scutellarin activates IDH1 to exert antitumor effects in hepatocellular carcinoma progression”的研究论文,发现天然小分子灯盏乙素(Suc)可以直接结合并激活IDH1(异柠檬酸脱氢酶1)进而抑制HCC细胞的生长。机制上,Scu结合在IDH1 Cys297,促进IDH1活性二聚体形成,增加HCC细胞中α-KG的产生,导致HIF1a泛素化和降解。而HIF1a的缺失下调HIF1a信号通路,进一步导致HCC细胞中糖酵解的抑制。该研究证实了IDH1-α-KG-HIF1a对HCC细胞生长的抑制作用,并发现了IDH1小分子激动剂Scu。

1、IDH1是Scu潜在的抗HCC靶点
作者利用生物素标记的Scu开展HuProt蛋白质组芯片检测,筛选到信号强度最高的潜在蛋白靶标IDH1,作者结合TCGA数据库发现IDH1在肝脏组织中高表达,且IDH1高表达组患者的无病生存期更长,且肝癌组织芯片的IHC同样证实IDH1在肝癌中表达低于正常组织。进一步利用HepG2细胞和荷瘤小鼠发现IDH1过表达明显抑制HepG2细胞的增殖,抑制体内肿瘤的生长。已有研究表明HIF1a受IDH1调控,作者发现缺氧条件下IDH1对HepG2细胞的抑制作用比常氧条件下更为明显,集落形成实验也表明在缺氧条件下IDH1对HepG2细胞的抑制作用最强,这些数据表明激活IDH1是一种潜在的抗肝癌策略,且IDH1是Scu的潜在抗肿瘤靶点。
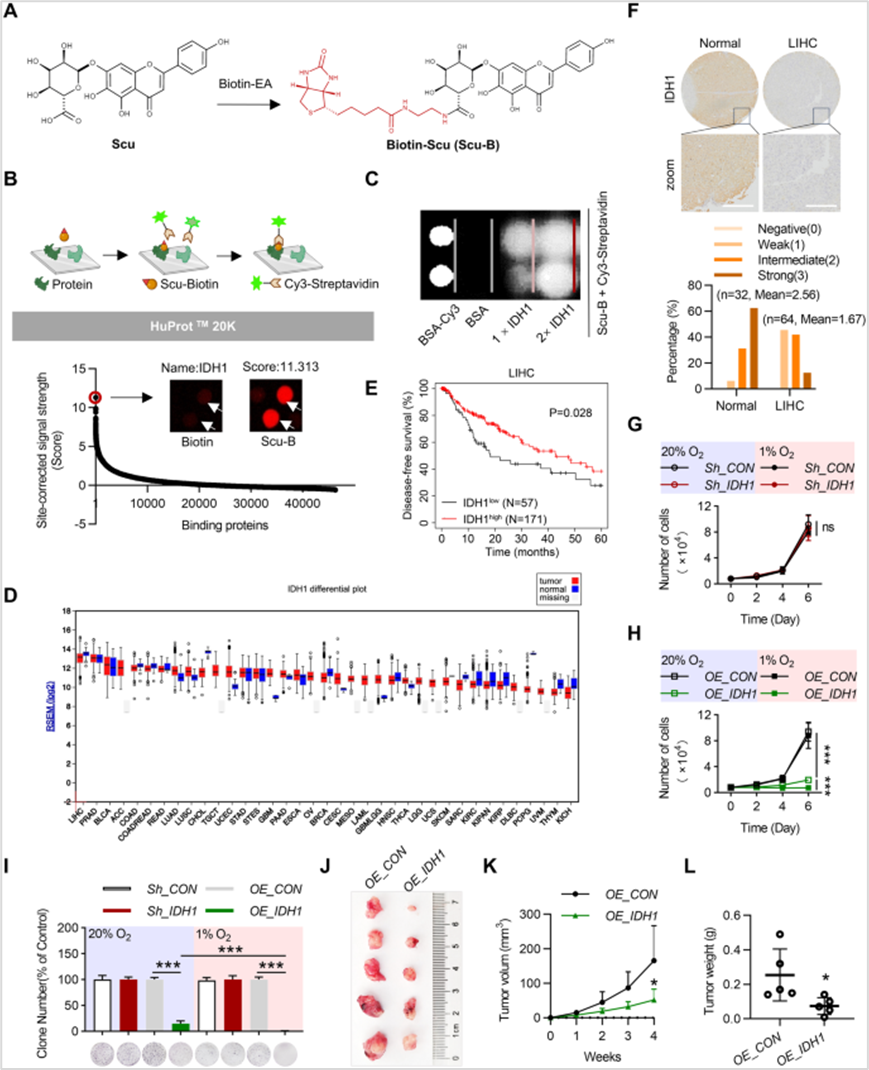
图1 IDH1是Scu潜在的抗HCC靶点
2、IDH1抑制HCC细胞的糖代谢重编程并激活肿瘤免疫微环境
通过CRISPR肝癌数据库发现CC细胞中IDH1蛋白表达与HIF1a表达呈负相关,进一步发现过表达IDH1使HepG2细胞中α-KG水平升高,HIF1a及其下游信号通路蛋白表达下调。由于糖酵解受HIF1a调控,作者检测发现IDH1的过表达抑制HepG2细胞的糖酵解,降低了HepG2细胞的葡萄糖消耗和乳酸产生。此外,免疫组织化学显示过表达IDH1的荷瘤小鼠肿瘤中增殖标志物Ki67以及HIF1a、GLUT1和VEGFA的表达降低,浸润CD4+和CD8+ T细胞、CD56+ NK细胞和F4/80+巨噬细胞的百分比显著增加,研究揭示了IDH1可以增加HCC细胞的免疫浸润,这可能与其逆转糖酵解表型有关。
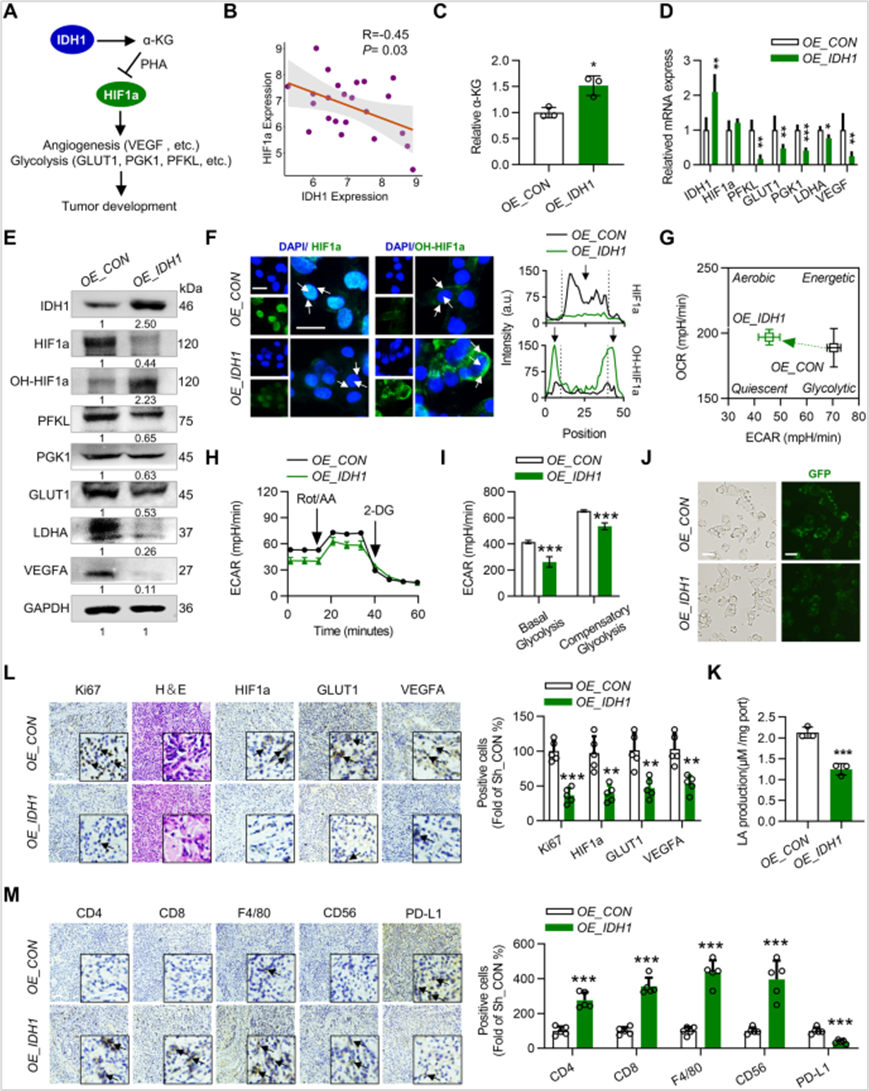
图2 IDH1抑制HCC细胞的糖代谢重编程并激活肿瘤免疫微环境
3、IDH1在Scu的抗癌活性中起关键作用
作者进一步研究了Scu在缺氧和常氧条件下对不同细胞系的抑制作用,发现除IDH1突变细胞外,所有肿瘤细胞在缺氧环境下对Scu的敏感性均显著提高,肿瘤细胞在缺氧条件下比在常氧条件下更多地依赖糖酵解来产生ATP,而Scu显著抑制肝癌细胞的糖酵解。为了验证IDH1是否是Scu在肝细胞癌细胞中的直接靶点,作者发现在体外和体内敲除IDH1均可显著消除Scu对肿瘤细胞增殖的抑制作用,且缺氧条件下IDH1蛋白表达与HIF1a表达呈显著负相关。研究表明IDH1是肝细胞癌细胞中并的重要靶点,肿瘤细胞对Scu的敏感性与IDH1的表达有关。
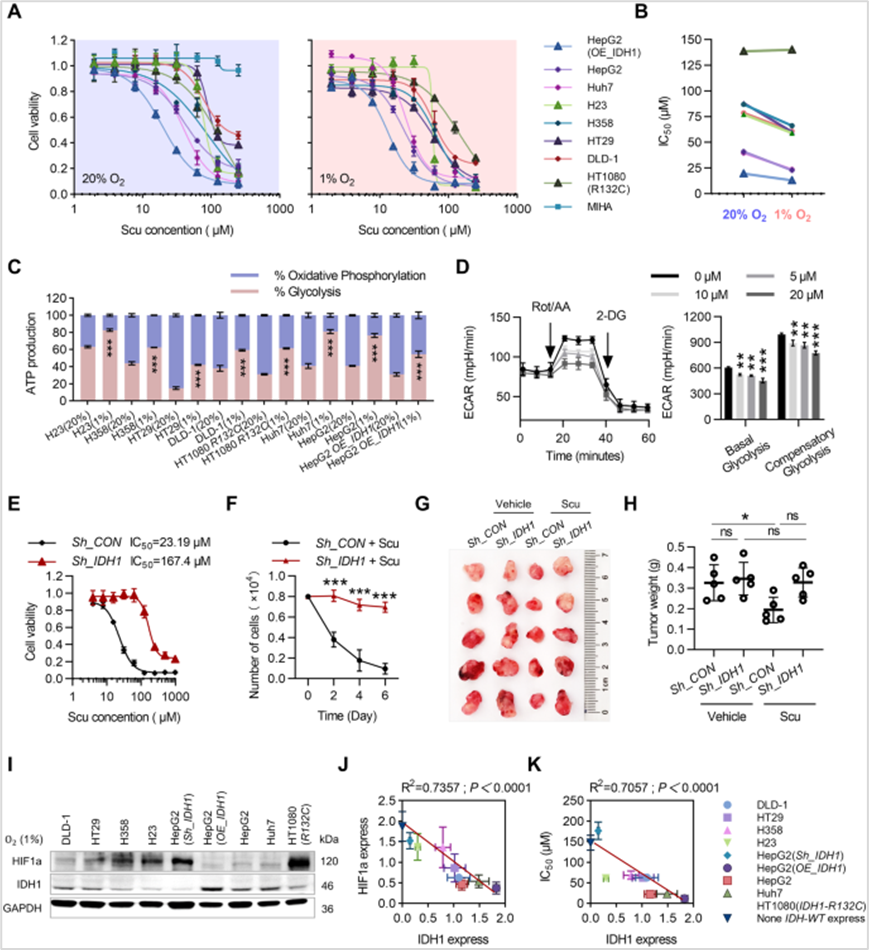
图3 IDH1在Scu的抗癌活性中起关键作用
4、Scu增强IDH1酶活性
作者进一步采用pulldown+MS显示Scu能够从HepG2裂解物中捕获IDH1,免疫荧光分析也显示了Scu与IDH1的结合。CETSA和差示扫描荧光法(DSF)、BLI分析均表明,ScuScu特异性结合IDH1。通过检测IDH1的转录和翻译水平发现Scu不通过转录或翻译调节IDH1。Scu处理后HepG2细胞中IDH1的主要代谢物之一α-KG的产量显著增加。相应地,Scu以剂量依赖性的方式增加了IDH1的活性,而Scu对突变蛋白IDH1-R132C的酶活性没有影响,结果表明Scu能够特异性地结合野生型IDH1并增强其酶活性。
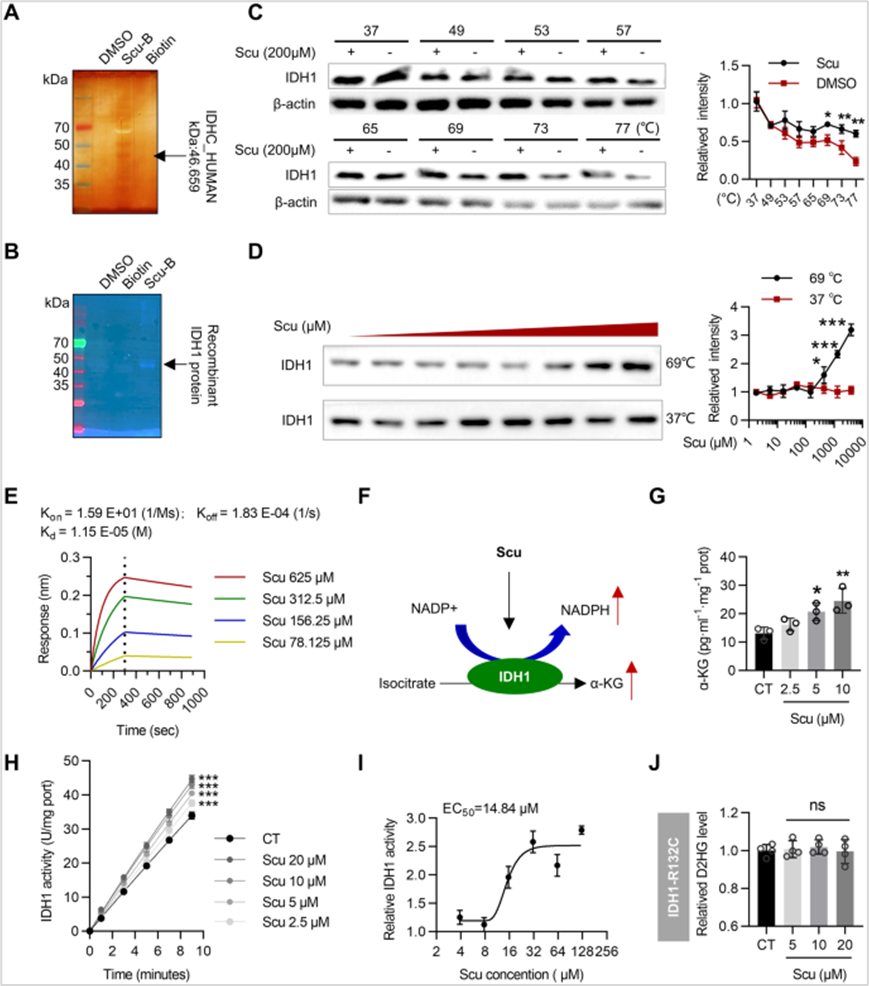
图4 Scu增强IDH1酶活性
5、Scu通过与IDH1共价结合增强IDH1酶活性
为了研究Scu与IDH1相互作用中涉及的残基,作者发现Scu与重组IDH1蛋白混合后,Scu的紫外可见吸收降低。其次,Scu和IAA有效地竞争IAA-yne对IDH1蛋白的标记。将IDH1与Scu孵育后进行LC-MS /MS分析,Cys297被鉴定为IDH1的Scu修饰的潜在结合位点。进一步对Cys297位点进行分子对接、RMSD值发现表明IDH1-Scu1模式是Scu激活剂机制最有可能的结合模式。作者还将IDH1的Cys269、Cys297和Cys379残基突变为丝氨酸残基,发现与IDH1 WT、C269S和C379S相比,C297S突变减弱了IDH1与Scu的结合。BLI结果显示Scu直接与IDH1蛋白结合,而不是与IDH1的C297S突变体结合,这表明共价修饰位点Cys297在Scu与IDH1的结合中起着至关重要的作用。从Scu的化学结构来看,它在a环上带有一个儿茶酚基团,暴露于空气中很容易被氧化形成正醌,可以与靶蛋白中的生物硫醇或半胱氨酸共价结合。作者结合LC-MS /MS的质量位移和分子对接验证了Scu与IDH1共价结合的可能模式,进一步研究发现Scu通过增加NADPH辅助因子的稳定性和促进IDH1二聚体的形成来激活IDH1。
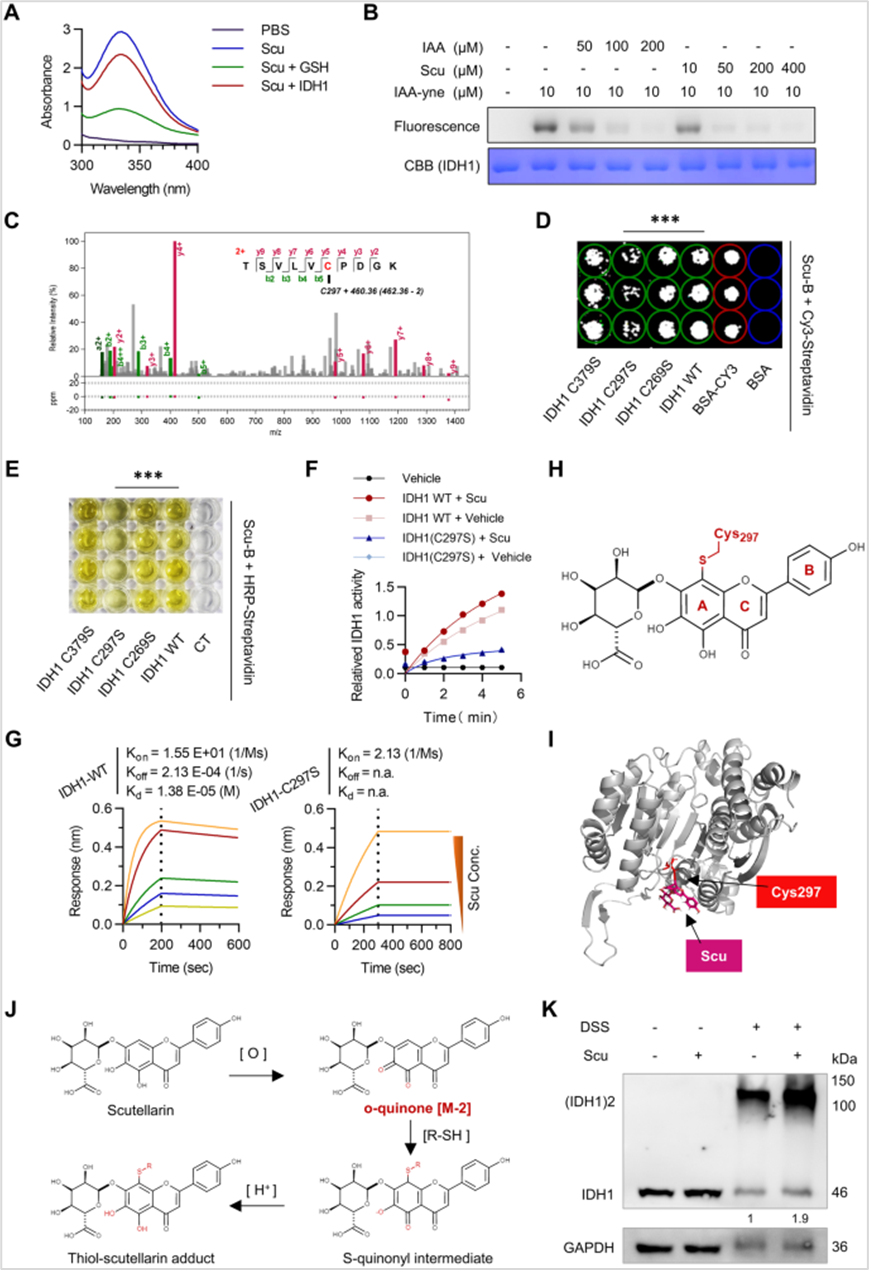
图5 Scu通过与IDH1共价结合增强IDH1酶活性
6、Scu通过肝癌细胞IDH1 -α-KG-HIF1a信号轴抑制糖酵解
进一步通过糖酵解途径的代谢组学分析发现Scu降低了细胞内糖酵解代谢物(丙酮酸、乳酸等)的水平,RNA-seq分析显示Scu下调了数十个已知的HIF1a转录靶点,包括糖酵解相关基因,GSEA显示Scu下调了HepG2细胞的糖酵解途径。同样,Scu在转录和翻译水平下调HIF1a下游信号PFKL、GLUT1、PGK1、LDHA和VEGFA的表达。然而,Scu下调了HIF1a的蛋白表达,但对HIF1a的转录没有影响。重要的是,Scu促进了IDH1的酶活性,导致α-KG的产生增加,这对于HIF1a的羟基化和降解很重要。进一步研究发现Scu和α-KG一样,促进HIF1a蛋白的羟基化,导致泛素化介导的HIF1a蛋白降解。接着使用三种不同类型的HIF1a激活剂验证了Scu对HIF1a靶点的调节作用。研究表明Scu通过IDH1-α-KG-HIF1a信号轴抑制HCC细胞增殖。
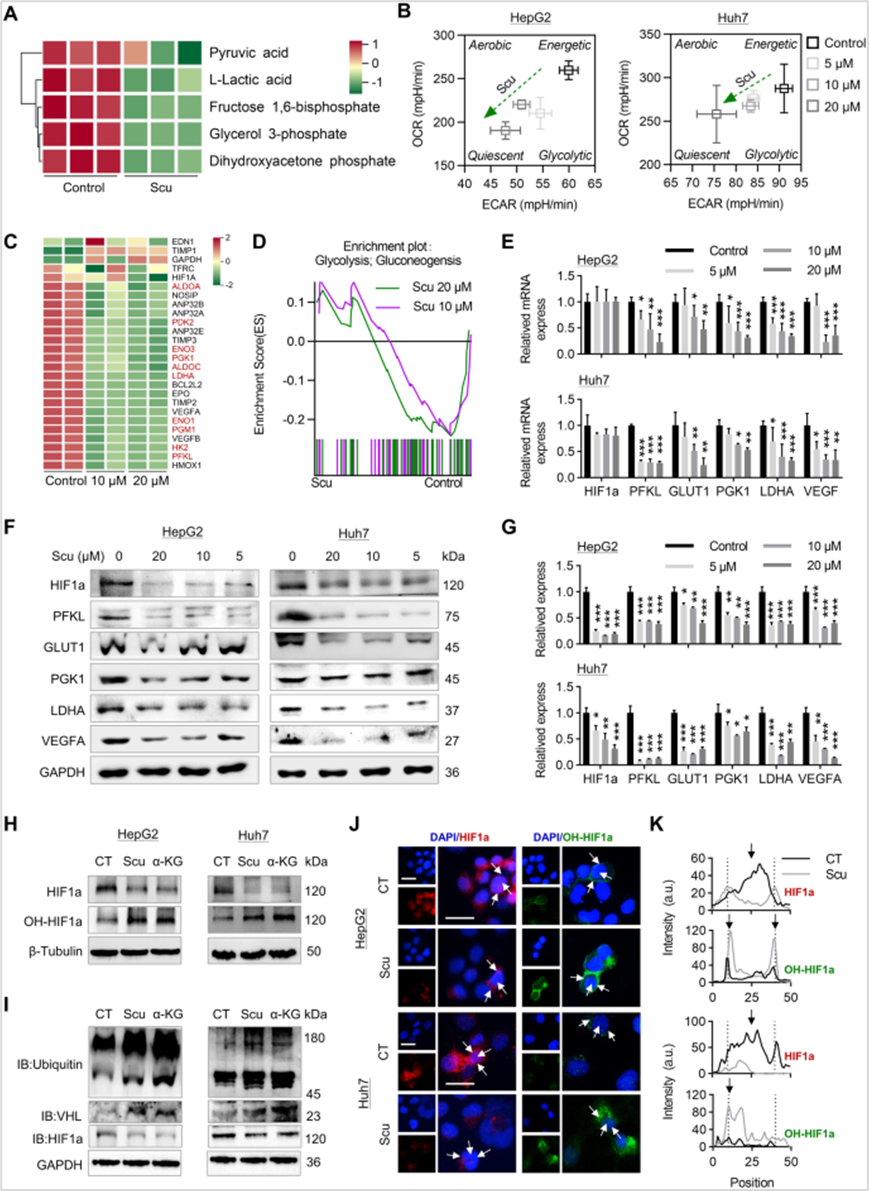
图6 Scu通过肝癌细胞IDH1 -α-KG-HIF1a信号轴抑制糖酵解
7、Scu通过激活IDH1抑制HIF1a激活肿瘤免疫微环境发挥抗肿瘤作用
最后,作者评估了Scu在体内的抗肿瘤活性,发现Scu明显抑制了H22肿瘤的生长。肿瘤的病理和免疫组织化学分析部分显示与对照相比,Scu显著增加Ki67-positive细胞的坏死面积和数量减少,减少PFKL,PGK1, GLUT1、LDHA和VEGFA的mRNA水平和少PFKL, PGK1, GLUT1、LDHA、VEGFA和HIF1a的蛋白质含量,上调肿瘤组织中IDH1酶活性和α-KG水平。免疫组化染色发现异种移植肿瘤中CD4+和CD8+ T细胞的数量显著增加,表明Scu增加了肿瘤中T细胞的浸润。此外,Scu处理的肿瘤中CD56+ NK细胞和F4/80+巨噬细胞的百分比高于对照肿瘤。这些结果表明Scu通过激活IDH1来抑制HIF1a诱导的肿瘤细胞环境酸化,从而激活肿瘤细胞的免疫微环境。
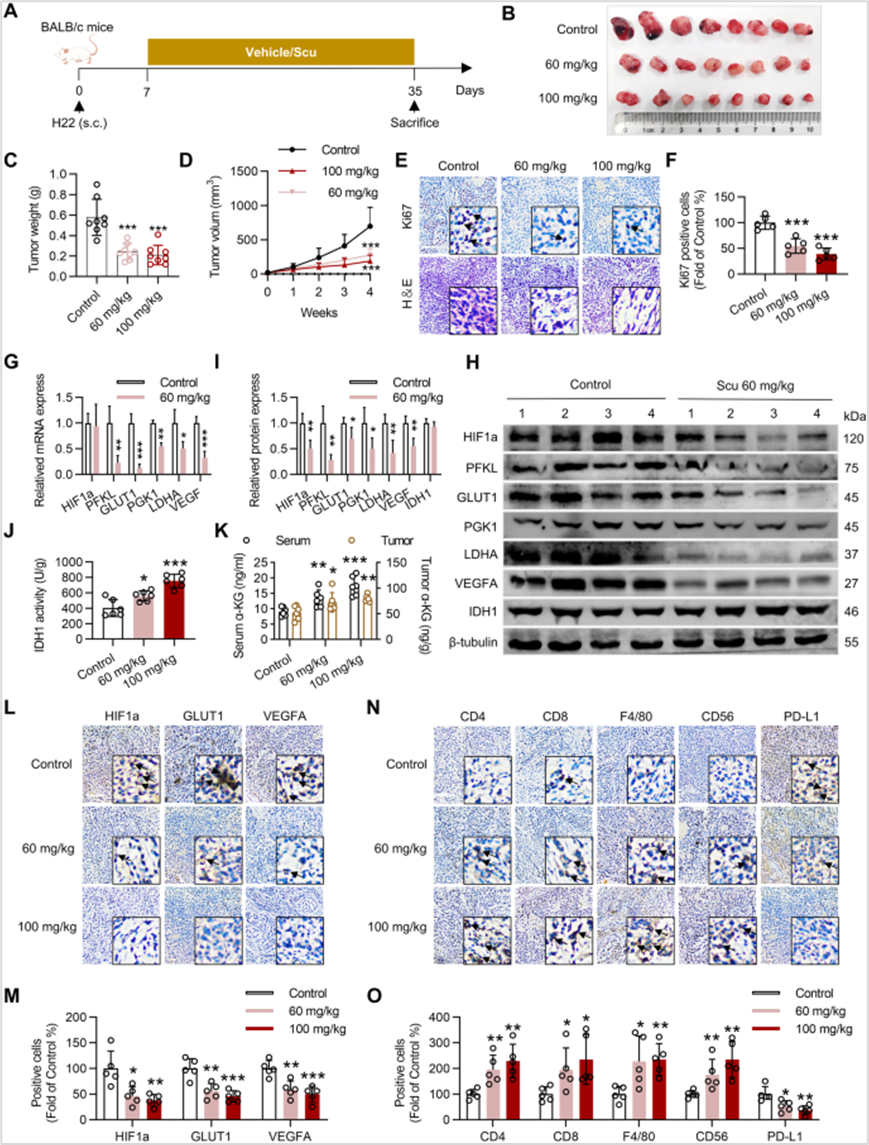
图7 Scu通过激活IDH1抑制HIF1a激活肿瘤免疫微环境发挥抗肿瘤作用
总结
研究发现Scu通过调节IDH1 -α-KG-HIF1a信号轴,在体内和体外抑制HCC的发展。此外,Scu促进了活性IDH1二聚体的形成,显著提高了HCC细胞中α-KG的水平。特别是,Cys297被鉴定为Scu靶向IDH1的关键共价结合位点。此外,Scu通过抑制肿瘤细胞糖酵解、招募免疫细胞进入肿瘤微环境,显示出显著的抗肝癌作用。总之,针对IDH1激活的抗肿瘤策略可能具有多种有益作用,该研究表明,Scu是IDH1的首个小分子激动剂,是一种潜在的新药。
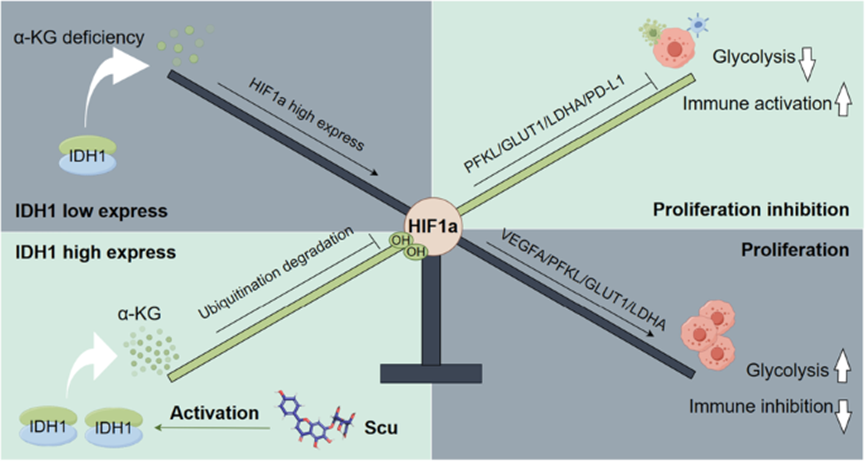
图8 灯盏乙素靶向IDH1下调糖酵解抑制肝癌进展
参考文献
Cui Z, Li C, Liu W, Sun M, Deng S, Cao J, Yang H, Chen P. Scutellarin activates IDH1 to exert antitumor effects in hepatocellular carcinoma progression. Cell Death Dis. 2024 Apr 15;15(4):267. doi: 10.1038/s41419-024-06625-6. PMID: 38622131; PMCID: PMC11018852.










